→ Definition: Bei der chronisch obstruktiven Lungenerkrankung handelt es sich um einen Sammelbegriff, der insbesondere die chronisch-obstruktive Bronchiolitis und das Lungenemphysem beinhaltet. Die Bronchialobstruktion ist typischerweise progredient, geht mit einer massiven Inflammationsreaktion der Lunge einher und ist auf schädliche Gase und Partikel zurückzuführen. Exazerbationen und Komorbiditäten bestimmen den Schweregrad der Erkrankung mit.
→ Epidemiologie:
→ I: Die COPD stellt eine Volkskrankheit dar; in Deutschland sind wahrscheinlich 10% der Erwachsenen an COPD (= chronic-obstructive-pulmonnary-disease) erkrankt (mit Tendenz steigend), wobei Männer häufiger als Frauen betroffen sind.
→ II: In den nächsten Jahren geht man davon aus, dass die COPD zur dritthäufigsten Todesursache nach Myokardinfarkt und Schlaganfall aufsteigt.
→ Ätiologie:
→ I: Hauptursache mit 80-90% der Fälle ist das aktive Zigarettenrauchen.
→ 1) Studien zeigen, dass bis zu 50% der Raucher eine COPD entwickeln, wobei insbesondere Frauen bei geringerer Rauchexposition empfänglicher für die Entwicklung einer COPD sind und einen deutlicheren FEV1-Abfall aufweisen.
→ 2) Weitere Faktoren: Sind u.a. Berufsnoxen (z.B. berufliche Stäube, Feinstaub, saure Aerosole, Stickoxide, Schwefeldioxid, etc.), rezidivierende Bronchialinfekte, Frühgeburtlichkeit, angeborener Alpha1-Antitrypsinmangel, etc.
→ II: Pathogenese:
→ 1) Im Mittelpunkt der Pathophysiologie steht die ausgeprägte Inflammation der großen und kleinen Atemwege (auf Ebene der Mucosa und Submucosa), die durch das Auftreten von neutrophilen Granulozyten, Makrophagen und evtl. Lymphozyten gekennzeichnet ist; Ursache ist durch die o.g. Noxen induzierte Aktivierung insbesondere auch der Alveolarmakrophagen und Epithelzellen. Die Makrophagenaktivierung wiederum bedingt die Freisetzung von proinflammatorischen Mediatoren wie TNF-Alpha, Interleukin 8 und B4, Sauerstoffmetaboliten sowie die Sezernierung von Proteasen (z.B. Matrixmetalloprotease).
→ 2) Durch die persistierende Entzündung destruieren die zilientragenden Zellen und werden im Sinne einer Metaplasie durch einfaches Plattenepithel ersetzt. Die bronchiale Obstruktion beruht zum einen auf der Zunahme des Mukus, einer Epithehyperplasie und nicht zuletzt auf Reparaturmechanismen mit nachfolgender Wandverdickung der Bronchien und Bronchiolen sowie konsekutiver Verringerung des Bronchialdurchmessers; zum anderen wird eine Vagusaktivierung im Bereich der kleinen Bronchien diskutiert, da diese überwiegend cholinerge Rezeptoren aufweisen (die bronchiale Hyperreaktivität z.B. beim Asthma bronchiale wird auch über Vagusbahnen gesteuert).
→ 3) Pathophysiologie: Pathophysiologisch bedingen die obstruktive Bronchiolitis und das Lungenemphysem während der Expiration ein Kollaps der Atemwege, der eine Lungenüberblähung verstärkt. Folge ist eine progredienter Verlust des focierten endexpiratorischen Volumens (= FEV1) und insuffizienter Expiration mit konsekutiver Lungenüberblähung.
→ Klinik: Charakteristisch bei der COPD ist der chronisch-progrediente (schleichende) Krankheitsverlauf; klassische Beschwerden sind Husten und Auswurf insbesondere am Morgen.
→ I: Initial besteht ein Belastungsdyspnoe nur bei Exazerbation, später im fortgeschrittenen Stadium auch eine Ruhedyspnoe (objektivierbare Abnahme des FEV1).
→ II: Eine sich entwickelnde Zyanose ist Zeichen einer Gasaustauschstörung; nicht selten kommt es zum Einsatz der Atemhilfsmuskulatur.
→ III: Bei Hyperkapnie manifestieren sich klinische Symptome wie Unruhe, Tremor, später Somnolenz und Hirndruckzeichen.
→ IV: Weitere Symptome: Die den gesamten Organismus betreffen sind u.a.:
→ 1) Gesamtorganismus: Gewichtsverlust und Kachexie.
→ 2) Herz/Kreislauf: Koronare Herzkrankheit und Herzinsuffizenz.
→ 3) Skelettmuskulatur: Mit Muskelschwäche und Muskelatrophie.
→ 4) Weitere Symptome: Osteoporose, Depression und nicht zuletzt Hormonmangel.
→ V: Exazerbration: Hierunter versteht man eine akute Verschlechterung bzw. Zunahme der Symptome wie Husten, Auswurf, Dyspnoe, thorakale Beklemmung sowie evl. Fieber (nicht selten aufgrund von viralen Atemwegsinfekten oder inhalativen Noxen, etc.), die sich insbesondere in der kalten Jahreszeit manifestiert und v.a. das Stadium II und III der COPD betrifft.
→ VI: Komplikationen: Wichtige und zum Teil schwerwiegende Komplikationen der chronisch-obstruktiven Lungenerkrankung sind insbesondere:
→ 1) Lungenemphysem.
→ 2) Vermehrte Rechtsherzbelastung mit Entwicklung eines Cor pulmonale.
→ 3) Respiratorische Insuffizienz.
→ Klinisch-relevant: Eine klinische Einweisung ist insbesondere in nachfolgenden Situationen indiziert:
→ A) Hinweis auf eine schwere Exazerbration.
→ B) Trotz intensiver und adäquater Behandlung ist der klinische Verlauf progredient.
→ C) Unzureichende häusliche Betreuung.
→ Klassifikation: In der Pneumologie existieren Schweregradeinteilungen der stabilen COPD zum einen
→ I: Unter Einbeziehung nachfolgender Parameter FEV1-Werte und klinischer Symptome.
→ 1) Leichte COPD: (= Schweregrad I) Klinische Symptome chronischer Husten und Auswurf. Atemnot wird häufig nicht bemerkt.
→ 2) Mittlere COPD: (= Schweregrad II) Hierbei manfestiert sich bei schwerer Belastung Dyspnoe.
→ 3) Schwere COPD: (= Schweregrad III) Klinisch ausgeprägt Dyspnoe bei leichter Belastung mit konsekutiver Einschränkung des Patienten.
→ 4) Sehrschwere COPD: Klinisch besteht eine respiratorische Insuffizienz. Im Spätstadium zeigt sich eine arterielle Hypoxie mit Hyperkapnie sowie ein Cor pulmonale mit peripheren Ödemen und Zeichen einer Rechtsherzinsuffizienz.
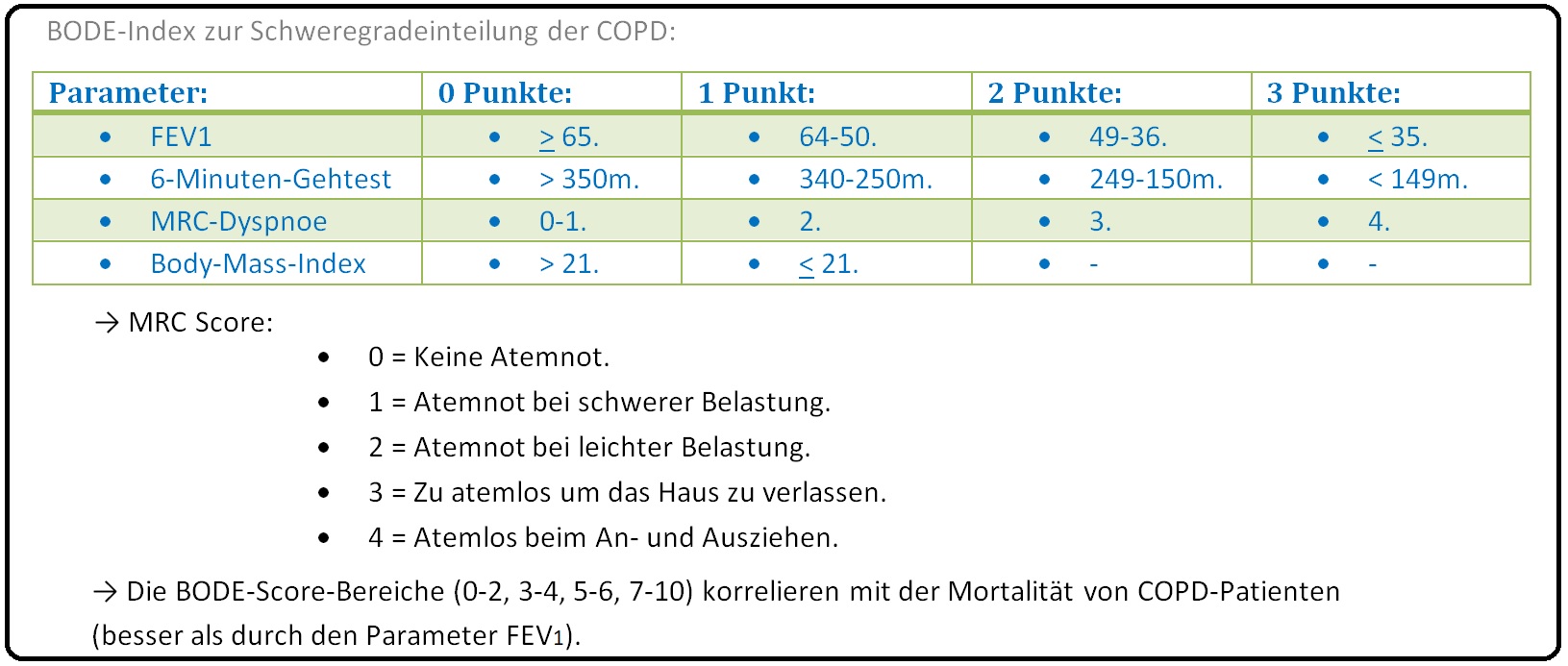
→ II: BODE-Index: Hierbei handelt es sich um eine neuere multimodale Schweregradeinteilung und beinhaltet:
→ 1) Body-Mass-Index,
→ 2) Obstruction,
→ 3) Dyspnoea und
→ 4) Exercise capacity (= Belastbarkeit).
→ Diagnose:
→ I: Anamnese/klinische Untersuchung:
→ 1) Eruierung von klinischen Symptomen wie Husten Auswurf, Risikofaktoren, wie Rauchen, etc. und nicht zuletzt Vorerkrankungen (häufige Infektionen der Atemwege, Alpha1-Antitrypsin-Mangel, etc.).
→ 2) Klinische Untersuchung: Nicht selten ist die körperliche Untersuchung unauffällig. Bei schweren Graden jedoch manifestieren sich Symptome einer Obstruktion mit verlängertem Exspirium, Giemen, Pfeiffen und nicht zuletzt Brummen, aber auch Zeichen einer Lungenüberblähung mit hypersonorem Klopfschall. Weitere klinische Charakteristika sind u.a. tiefstehende wenig verschiebliche Atemgrenzen, Fassthorax, Zeichen eines Cor pulmonale, periphere Ödeme, zentrale Zyanose, Kachexie, Einsatz der Atemhilfsmuskulatur.
→ II: Labor: Bestimmung der arteriellen Blutgase (Abb.: Normwerte der BGA) in Ruhe und unter Belastung für die Beurteilung des Gasaustausches.
→ III: Lungenfunktionsdiagnostik: Hierzu zählen insbesondere die Spirometrie, Fuss-Volumen-Diagramme oder die Ganzkörperplethysmographie. Wichtige Kenngrößen hierbei sind die 1-Sekunden-Kapazität (FEV1: Ein jährlicher Verlust von mehr als 100ml weist auf eine beginnende COPD hin) und die inspiratorische Vitalkapazität (VC) sowie das errechnete Verhältnis aus FEV1/VC. Zusätzlich geben die inspiratorische Einsekundenkapazität (FIV1) sowie die inspiratorische Kapazität (IC) Auskunft über eine mögliche Überblähung der Lungen mit konsekutiver Beeinträchtigung.
→ IV: Reversibilitätstest:
→ 1) Bronchdilatatoren: Es geht um die Reaktion der Atemwegsobstruktion nach Applikation von Bronchodilatatore; das Verfahren dient v.a. der Differenzialdiagnose Asthma bonchiale und COPD.
→ 2) Glukokortikoide: Auch dieses Testverfahren dient der Unterscheidung zwischen Asthma und COPD.
→ V: Bildgebung:
→ 1) Röntgen: Thorax in 2 dient der Darstellung von Emphysem-Blasen und weiteren wichtigen Veränderungen wie Infiltrationen (z.B. bei Pneumonie), Stauung oder Raumforderungen, etc.
→ 2) HRCT: (hochauflösend) Zur Darstellung von Verteilung und Schweregrad eines Lungenemphysems.
→ VI: Mikrobiologische Sputumuntersuchung sind insbesondere indiziert bei.
→ Differenzialdiagnose: Von der COPD müssen insbesondere nachfolgende Erkrankungen abgegrenzt werden:
→ I: Pulmonal: Erkrankungen wie Broniektasen, Asthma bronchiale, respiratorische Bronchiolitis, Bronchiolitis obliterans, Tuberkulose.
→ II: Herzinsuffizienz,
→ III: Immungobulin-Magel.
→ Therapie:
→ I: Zur Dauertherapie zählen die Vermeidung von Noxen insbesondere die Zigarettenabstinenz, zudem aber auch Schutzimpfungen gegen Influenza und Pneumokokken sowie bei schwerer COPD die Sauerstofftherapie.
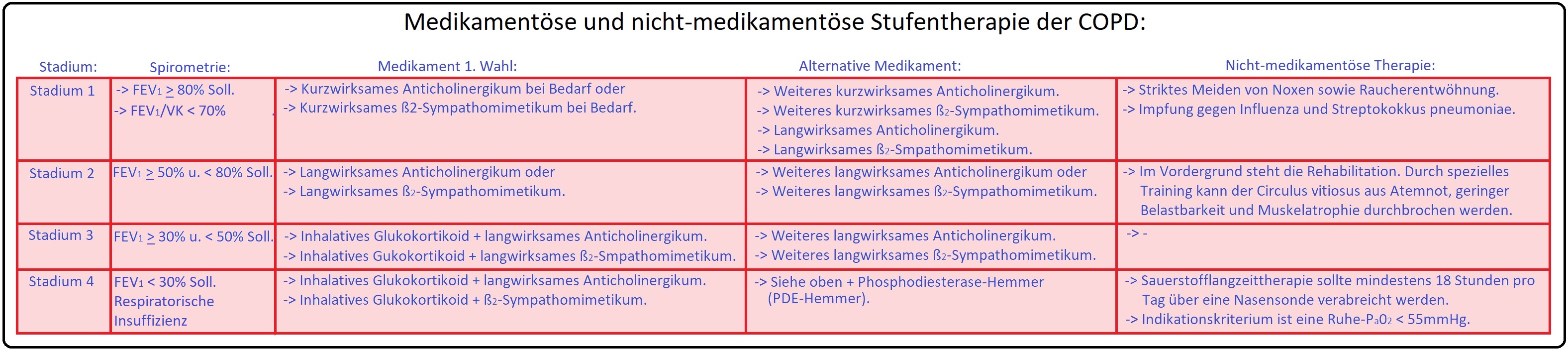
→ II: Medikamentöse Therapie: Zur Langzeittherapie der COPD stehen mehrere Substanzgruppen zur Verfügung.
→ 1) Bronchialdilatatoren stellen ein Basistherapeutikum der symptomatischen COPD dar, indem sie den Bronchialmuskeltonus und konsekutiv den Atemwiderstand vermindern.
→ 2) Bei den ß2-Sympathomimetika unterscheidet man zwischen kurzwirksamen (z.B. Fenoterol, Salbutamol, Terbutalin mit einer Wirkdauer von 4-6 Stunden) und langwirksame ß2-Sympathomimetika (z.B. Salmeterol, Formoterol mit einer Wirkdauer von 12 Stunden).
→ 3) Theophyllin wird nur in der Langzeittherapie als Retardpräparat eingesetzt und ist aufgrund der vermehrten unerwünschten Effekte, der geringen therapeutischen Breite, etc. sehr limitiert. Insofern wird es nur eingesetzt, wenn Anticholinergika und oder ß2-Sympathomimetika nicht ausreichend wirksam sind.
→ 4) Bei den Anticholinergika stehen die kurzwirksamen (Ipratropium) und langwirksame Anticholinergika zu Verfügung. Tiotropiumbromid ist ein langwirksames Anticholinergikum und führt zu einer 24-stündigen anhaltenden Bronchodilatation sodass es nur einmal täglich appliziert werden muss.
→ 5) Glukokortikoide: Bei symptomatischen COPD-Patienten im Stadium III und IV ist eine Dauertherapie mit inhalativen Glukokortikoiden indiziert, insbesondere wenn der FEV1 < 50% des Sollwertes liegt und zusätzlich mindestens 1 Exazerbation im Vorjahr aufgetreten ist. Systemische Glukokortikoide wiederum sollten in der Dauertherapie nur im Ausnahmefall eingesetzt werden, da mit einer erhöhten Mortalität zu rechnen ist.
→ III: Nicht-medikamentöse Therapien: Hierzu zählen insbesondere Raucherentwöhnung, Patientenschulung, Ernährungsberatung, Atemphysiotherapie und nicht zuletzt die Rehabilitation.
→ IV: Sauerstoff-Langzeittherapie: Therapieziel hierbei ist das Anheben des arteriellen O2-Partialdrucks auf Werte > 60mmHg, um insbesondere eine Entlastung der der Atemhilfsmuskulatur, Reduzierung der Progression einer pulmonalen Hypertonie, Verbesserung der Belastbarkeit etc. Die Indikationen für eine Sauerstofftherapie sind insbesondere:
→ 1) PaO2 < 55mmHg mit oder ohne Hyperkapnie.
→ 2) PaO2 Werte zwischen 55-59mmHg bei Nachweis einer pulmonalen Hypertonie, peripheren Ödemen, Nachweis einer Herzinsuffizienz oder einer Polyglobulie (HK > 55%). So ist bei allen Formen von Sauerstoffmangels, die nicht unter Belastung auftreten, eine (mindestens) 16-stündige Sauerstoffapplikation pro Tag indiziert.